氨气,Ammonia, NH3,无色气体。有强烈的刺激气味。密度 0.7710。相对密度0.5971(空气=1.00)。易被液化成无色的液体。在常温下加压即可使其液化(临界温度132.4℃,临界压力11.2兆帕,即112.2大气压)。沸点-33.5℃。也易被固化成雪状固体。熔点-77.75℃。溶于水、乙醇和乙醚。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸、铵盐和胺类等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜,人吸入过多,能引起肺肿胀,以至死亡 。
分子结构
 氨气
氨气
氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。
物质性质
氨气的性质:无色气体,有刺激性气味、密度小于空气、极易溶于水(且快)。常温时,1体积水大约溶解700体积氢。溶于水发生以下反应使水溶液呈碱性:NH₃+H₂O====NH₃·H2O(NH4OH)====NH4⁺+OH- (可逆)可作红色喷泉实验。生成的一水合氨NH₃·H2O(NH4OH)是一种弱碱,很不稳定,会分解,受热更不稳定:NH₃·H2O(NH4OH)===(△) NH₃ ↑+H₂O
浓氨水易挥发出氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐:NH₃+HCl == NH4Cl (晶体)
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。
铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4Cl====NH₃ ↑+HCl ↑
NH4HCO₃====NH3 ↑+H2O ↑+CO2 ↑
可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热)
NH4NO3+NaOH====NaNO3+H2O+NH3 ↑
2NH4Cl+Ca(OH)2====CaCl2+2H2O+2NH3 ↑
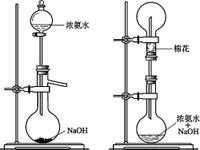
氨气可以用向下排空气法收集,用红色石蕊试纸检验是否收集满,用氢氧化钠溶液处理尾气。
基本性质
物理性质
相对分子质量 17.031
 氨气
氨气
氨气在标准状况下的密度为0.7081g/L
氨气极易溶于水,溶解度1:700
临界点:133℃,11.3Atm
EINECS号: 231-635-3
无色有刺激性恶臭的气体;蒸汽压 506.62kPa(4.7℃);熔点 -77.7℃;沸点-33.5℃;溶解性:极易溶于水,相对密度(水=1)0.82(-79℃);相对密度(空气=1)0.6;稳定性:稳定;危险标记 6(有毒气体);主要用途:用作制冷剂及制取铵盐和氮肥
|
1
|
名称
|
氨
|
|
2
|
化学式
|
NH3
|
|
3
|
CAS 注册号
|
7664-41-7
|
|
4
|
相对分子质量
|
17.031
|
|
5
|
熔点
|
195.41K,-77.74℃,-107.93oF
|
|
6
|
沸点,101.325kPa(1atm)
|
239.72K,-33.43℃,-28.17oF
|
|
7
|
临界温度
|
405.65K,-132.5℃,-270.5oF
|
|
8
|
临界压力
|
11.3mPa,112.78bar,111.3atm,1635.74psia
|
|
9
|
临界体积
|
72.47cm3/mol
|
|
10
|
临界密度
|
0.235g/cm3
|
|
11
|
临界压缩系数
|
0.242
|
|
12
|
偏心因子
|
0.252
|
|
13
|
液体刻密度 ,25℃时
|
0.602g/cm3
|
|
14
|
液体热膨胀系数 ,25℃时
|
0.0025 1/℃
|
|
15
|
表面张力 ,25℃时
|
19.75×10-3 N/m,19.75dyn/cm
|
|
16
|
气体密度 ,101.325 kPa(atm)和70 oF(21.1℃)时
|
0.705kg/m3 ,0.0440 lb/ft3
|
|
17
|
气体相对密度,101.325 kPa(1atm)和70oF时(空气=1)
|
0.588
|
|
18
|
汽化热 , 沸点下
|
1336.97kj/kg,574.9BTU/1b
|
|
19
|
熔化热 , 熔点下
|
332.16kj/kg,142.83BTU/1b
|
|
20
|
气体定压比热容 cp,25℃时
|
2.112kj/(kg? k),0.505BTU/(1b·R)
|
|
21
|
气体定容比热容 cp,25℃时
|
1.624kj/(kg? k),0.388BTU/(1b·R)
|
|
22
|
气体比热容比 , cp/cv
|
1.301
|
|
23
|
液体比热容 ,25℃时
|
4.708kj/(kg?k ),1.125BTU/(1b·R )
|
|
24
|
因体比热容 ,-103℃时
|
2.189kj/(kg?k ),0.523BTU/(1b·R )
|
|
25
|
气体摩尔熵 ,25℃时
|
192.67j/(mol?k )
|
|
26
|
气体摩尔生成熵,25℃时
|
-98.94j/(mol?k )
|
|
27
|
气体摩尔生成焓 ,25℃时
|
-45.9kj/mol
|
|
28
|
气体摩尔吉布斯生成能 ,25℃时
|
-16.4kj/mol
|
|
29
|
溶解度参数
|
29.217(j/cm3 )0.5
|
|
30
|
液体摩尔体积
|
24.993cm3 /mol
|
|
31
|
在水中的溶解度 ,25 ℃时
|
全溶
|
|
32
|
辛醇 -水分配系数 ,lgKow
|
---
|
|
33
|
在水中的亨利定律常数 ,25 ℃时
|
---
|
|
34
|
气体黏度 ,25℃时
|
101.15×10-7Pa ?s,101.15μP
|
|
35
|
液体黏度 ,25℃时
|
0.135mPa ?s,0.082cp
|
|
36
|
气体热导率 ,25℃时
|
0.02466W/(m ? k)
|
|
37
|
液体热导率 ,25℃时
|
0.5024W/(m ? k)
|
|
38
|
空气中爆炸低限含量
|
16.1%( φ )
|
|
39
|
空气中爆炸高限含量
|
25%( φ )
|
|
40
|
闪点
|
---
|
|
41
|
自燃点
|
651.1℃,1204oF
|
|
42
|
燃烧热 ,25℃(77oF)气态时
|
18603.1kj/kg,7999.3BTU/1b
|
|
43
|
美国政府工业卫生工作者会议 (ACGIH) 阈值浓度
|
25×10-6(φ )
|
|
44
|
美国职业**与卫生管理局 (OSHA) 允许浓度值
|
50×10-6(φ )
|
|
45
|
美国国立职业**与卫生研究所 (NIOSH) 推荐浓度值
|
25×10-6(φ )
|
化学性质
1、与水反应
氨在水中的反应可表示为:NH3+H2O=NH3·H2O
一水合氨不稳定受热分解生成氨和水
氨水中存在三分子、三离子、三平衡
分子:NH3.NH3·H2O、H2O;
离子:NH4+、OH-、H+;
三平衡:NH3+H2O====NH3·H2O====NH4++OH- (可逆)
H2O====H++OH- (可逆)
氨水在中学化学实验中三应用
①用蘸有浓氨水的玻璃棒检验HCl等气体的存在
②实验室用它与铝盐溶液反应制氢氧化铝
③配制银氨溶液检验有机物分子中醛基的存在。
2、与酸反应
2NH3+H2SO4===(NH4)2SO4
NH3+HCl===NH4Cl
3NH3+H3PO4===(NH4)3PO4
NH3+CO2+H2O===NH4HCO3
(反应实质是氨分子中氮原子的孤对电子跟溶液里具有空轨道的氢离子通过配位键而结合成离子晶体。若在水溶液中反应,离子方程式为:
8NH3+3Cl2===N2+6NH4Cl
(黄绿色褪去,产生白烟)
反应实质:2NH3+3Cl2===N2+6HCl
NH3+HCl===NH4Cl
总反应式:8NH3+3Cl2===N2+6NH4Cl
3、与氧气反应
4NH3+3O2==点燃==2N2+6H2O(纯氧)
4、与碳反应
NH3+C=加热=HCN+H2↑(剧毒氰化氢)
5、液氨的自偶电离
液氨的自偶电离为:
2NH3==(可逆)NH2- + NH4+ K=1.9×10^-30(223K)
6、取代反应
取代反应的一种形式是氨分子中的氢被其他原子或基团所取代,生成一系列氨的衍生物。另一种形式是氨以它的氨基或亚氨基取代其他化合物中的原子或基团,例如;
COCl2+4NH3==CO(NH2)2+2NH4Cl
HgCl2+2NH3==Hg(NH2)Cl+NH4Cl
这种反应与水解反应相类似,实际上是氨参与的复分解反应,故称为氨解反应。
7、与水、二氧化碳
NH3+H2O+CO2==NH4HCO3
该反应是侯氏制碱法的**步,生成的碳酸氢铵与饱和氯化钠溶液反应生成碳酸氢钠沉淀,加热碳酸氢钠制得纯碱。
此反应可逆,碳酸氢铵受热会分解
NH4HCO3=(加热)=NH3↑+CO2↑+H2O
8、与氧化物反应
3CuO+2NH3 ==加热==3Cu+3H2O+N2
这是一个氧化还原反应,也是实验室常用的临时制取氮气的方法,采用氨气与氧化铜共热,体现了氨气的还原性。
制造方法
工业制法
工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成:
工业上制氨气
高温高压
N2+3H2==高温高压催化剂===2NH3(可逆反应)
催化剂
△rHθ =-92.4kJ/mol
实验室制备
实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备: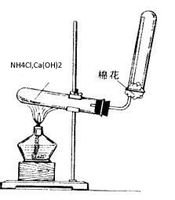 氨气2NH4Cl(固态) + Ca(OH)2(固态)===2NH3↑+ CaCl2 + 2H2O
氨气2NH4Cl(固态) + Ca(OH)2(固态)===2NH3↑+ CaCl2 + 2H2O
Li3N + 3H2O === 3LiOH + NH3↑
实验室快速制得氨气的方法
用浓氨水加固体NaOH(或加热浓氨水)
氨气检测仪
1.泵吸式氨气检测仪
CY-NH3泵吸式氨气检测仪采用内置吸气泵,可快速检测工作环境中氨气浓度。泵吸式氨气检测仪采用进口电化学传感器,具有非常清晰的大液晶显示屏,声光报警提示,保证在非常不利的工作环境下也可以检测危险气体并及时提示操作人员预防。
2.便携式氨气检测仪
HFPCY-NH3便携式氨气泄漏检测仪,可连续检测作业环境中氨气浓度。氨气检测仪为自然扩散方式检测气体浓度,采用进口电化学传感器,具有极好的灵敏度和出色的重复性;氨气检测仪采用嵌入式微控制技术,菜单操作简单,功能齐全,可靠性高,整机性能居国内**水平。检测仪外壳采用高强度工程材料、复合弹性橡胶材料精制而成,强度高、手感好。
3.在线式氨气报警器
HFTCY-NH3在线式氨气检测报警器由气体检测报警控制器和固定式氨气检测器组成,气体检测报警控制器可放置于值班室内,对各监测点进行监测控制,氨气检测器安装于气体*易泄露的地点,其核心部件为气体传感器。氨气检测器将传感器检测到的氨气浓度转换成电信号,通过线缆传输到气体检测报警控制器,气体浓度越高,电信号越强,当气体浓度达到或超过报警控制器设置的报警点时,气体检测报警控制器发出报警信号,并可启动电磁阀、排气扇等外联设备,自动排除隐患。在线式氨气检测报警器广泛应用于石油、化工、冶金、电力、煤矿、水厂等环境,有效防止爆炸事故的发生。
主要用途
氨用于制造氨水、氮肥(尿素、碳铵等)、复合肥料、硝酸、铵盐、纯碱等,广泛应用于化工、轻工、化肥、制药、合成纤维等领域。含氮无机盐及有机物中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等都需直接以氨为原料。此外,液氨常用作制冷剂,氨还可以作为生物燃料来提供能源。
